白と藍色の駒場祭
化学部の部誌を読むための光速高校化学 ~第二章~
藍色の聖騎士
城南 かがな

東京大学教養学部化学部に所属する14歳の中学2年生。きのこ派。
藍上 たくと

東京大学教養学部化学部に所属する14歳の中学2年生。たけのこ派。
ミスリー・ラヴァケット

東京大学教養学部化学部に所属する15歳の高校1年生。小枝派。
(画像出典:Waifu Labs https://waifulabs.com/)

かがな
「ふぅ……
まさか本当に警察が来るとはね~」

たくと
「いや~、こっそり五千円渡したら帰ってくれるかな~と思ったんだけどな」

かがな
「一番ダメでしょ!!
それのせいだよ!!」

ミスリー
「ごめんなさいね。本当に履いてるとは思わなかったわ」

たくと
「僕、普段どんな奴だと思われてるんだろう」

かがな
「たまに変なこと言うけど、変態だなんて思ってないよ……
そ、そうだ!ところで、電子を詳しく見てみるんでしたよね?」

ミスリー
「そうだったわね。
原子核の周囲の電子には、それぞれ決められた軌道があるわ。
こんな風に、内側から順にK殻、L殻、M殻……と並んでいるわね」

図3:ボーアモデルにおける電子の軌道図(出典:http://kagakumania.seesaa.net/article/414632984.html)

たくと
「どうしてアルファベットがKから始まってるんだろう?」

かがな
「もしかして、発見した時点の一番内側をA殻にしちゃうと
後でもっと内側の軌道が見つかったときに困るから、
わざと真ん中あたりの文字から始めただけだったりして……」

ミスリー
「その通りよ。
アルファベットのKには『真ん中あたり』以上の意味はないわ」

かがな
「えぇ…………」

ミスリー
「さあ、どんどんいくわね。
この図は周期表でいう第3周期までにある原子の電子軌道の表よ」
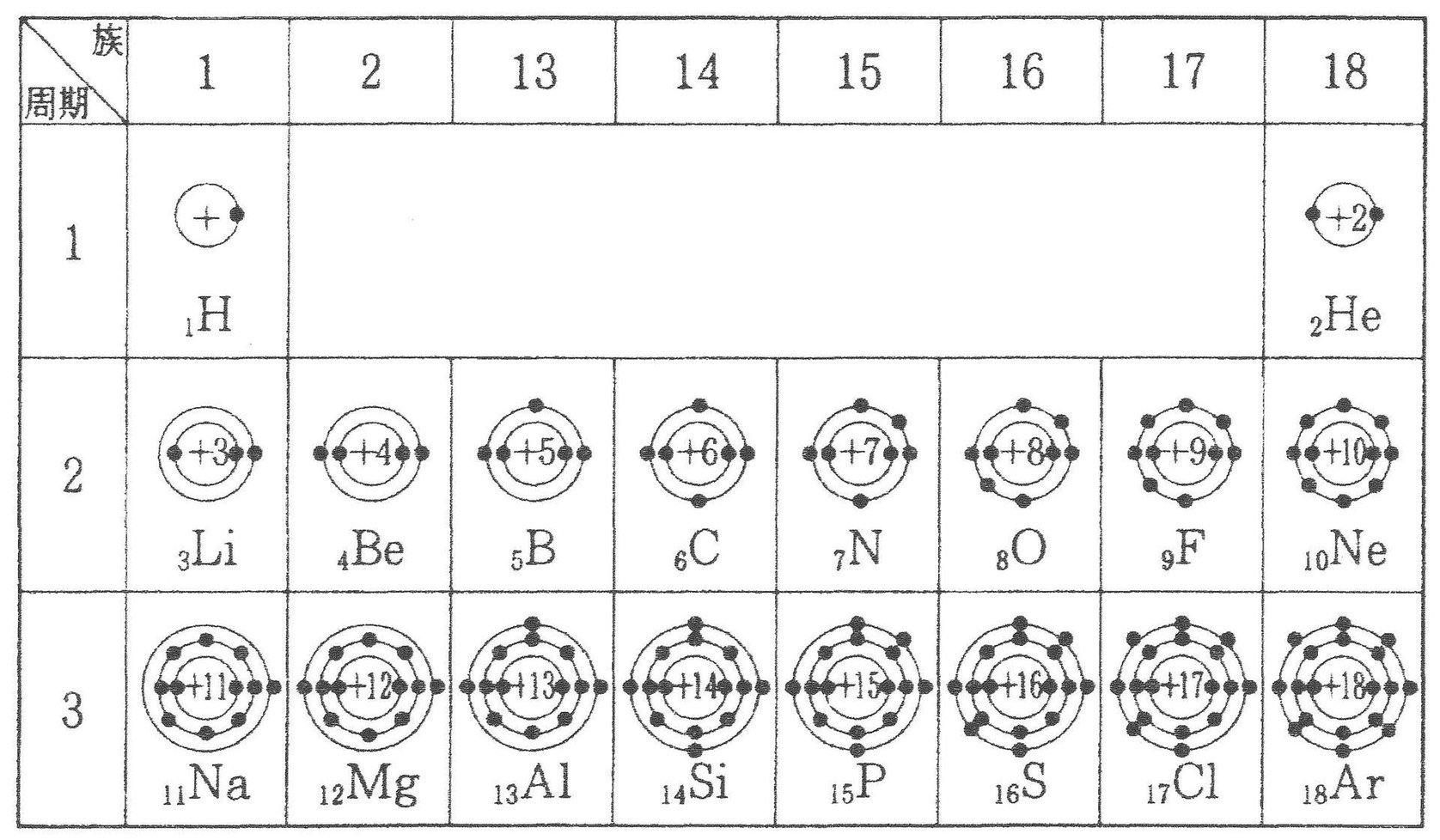
図4:第3周期までの元素とその電子配置図(出典:http://kagakumania.seesaa.net/article/414632984.html)

かがな
「内側の殻から、順番に埋まっていくんですね」

ミスリー
「あとで励起の話をするときに詳しく話すけど、
基本的には内側から埋まっていくと思って問題ないわ。
外側の軌道に入るには、エネルギーが必要なの」

たくと
「周期表の真ん中がへこんだ形は、
電子の埋まり方に従って元素を整理した結果なんですね」

ミスリー
「そうね。もっとも内側のK殻には2つまで電子を収めることができて、
3番目の原子のリチウムの3つ目の電子はそれより外側のL殻に入るから、
リチウムは水素やヘリウムよりも1段下の第2周期に書かれているわね」

かがな
「じゃあ同じようにL殼には8つまで電子が収まって、
11番目のナトリウムではさらに外側のM殼に電子が1つ入る、
ってことですね!」

ミスリー
「その通り。正解よ。
で、M殻には18個まで電子を収容できるんだけど……」

たくと
「周期表だと、M殻に電子が8個のアルゴンで折り返しですね」

ミスリー
「そうなの。19番目のカリウムはM殻の電子が8つのまま
外側のL殻に電子が1つ入っているわ」

図5:カリウムの電子配置図(出典:Wikipedia「カリウム」)

たくと
「その場合はさっきとは逆に、
外側の軌道にいる方が電子の持つエネルギーが小さい、
ってことですか?」

ミスリー
「そういうことになるわ。実は……
M殻に電子を9つ以上入れようとするとL殻よりエネルギーが大きくなってしまう理由は、高校化学では説明できないの。
大学で習う『シュレーディンガー方程式』という式を解くと出てくるんだけど、この解の導出はとても長くて複雑で、中学生のみんなにここでさくっと教えるのには向かないわ。
どうしても気になったら、書店の物理化学や量子化学のコーナーに行ったり、インターネットで調べたりすることをお勧めするわ。
書籍なら、真船文隆『量子化学 基礎からのアプローチ』がとても詳しいわね」

かがな
「う~ん……
とにかく電子の持つエネルギーが小さい形のほうが安定、
ってことですね!」

ミスリー
「そうね。結果としては第2周期と第3周期の元素に関して、
『最外殻の電子殼は電子8つで安定する』という規則が成り立つわ。
『オクテット則』とか呼んだりするわね」

かがな
「うぅ……
なんか……眠くなってきちゃいました……」

ミスリー
「あら、じゃあちょっとコンビニでも飲みましょうか」

たくと
「実験室は飲食禁止ですよ!」

かがな
「ええええええ!?いやいやいやいや!!
そもそもコンビニは飲めないよ!!」
第三章へ続く……