白と藍色の駒場祭
化学部の部誌を読むための光速高校化学 ~第三章~
白き翼の大天使
城南 かがな

東京大学教養学部化学部に所属する14歳の中学2年生。好きな元素はテルル。
藍上 たくと

東京大学教養学部化学部に所属する14歳の中学2年生。好きな元素はクリプトン。
ミスリー・ラヴァケット

東京大学教養学部化学部に所属する15歳の高校1年生。元素は全部好き。
(画像出典:Waifu Labs https://waifulabs.com/)

たくと
「う~ん……悩むなぁ……」

かがな
「あっ!!
休憩時間中まで部誌のことを考えてくれてるなんて……
たくとって意外と真面目なとこあるんだね!」

たくと
「御三家どれ選ぼう……」

かがな
「あ、あぁ…………
私もそれおととい買ったよ!
私が選んだのはね、頭の上に草が生えたカメみたいな……えっと……」

ミスリー
「あら、たくと、いいこと聞いたじゃない。
炎は草に強いわ。そこのサルを選べばローカル対戦でガン有利よ」

かがな
「ええぇっ!!血も涙もない!!」

たくと
「なるほど、いいことを聞きました。
でも……かがなが言った通り、部誌のこともそろそろ考えなきゃな。
どうやったらいろんな人に見てもらえるだろう……」

ミスリー
「そんなの決まってるわ。より多くの人に見てもらうには、タイトルを
【令和最新版‼】BDSP全ストーリー究極攻略

かがな
「ド大嘘じゃないですか!!」

ミスリー
「ふふっ、冗談よ。一生懸命書いた記事なら、きっとみんな読んでくれるわ。
ところで……確かオクテット則のことまでは話したんだったわよね?」

たくと
「第2周期と第3周期の元素の最外殻の電子殼が、
電子8つで安定するってやつですよね」

ミスリー
「そうよ。そしてこのオクテット則のおかげで、
最外殻の電子数が8つでない原子は、ほかの原子と電子を交換して、
安定な状態になろうとするわ。」
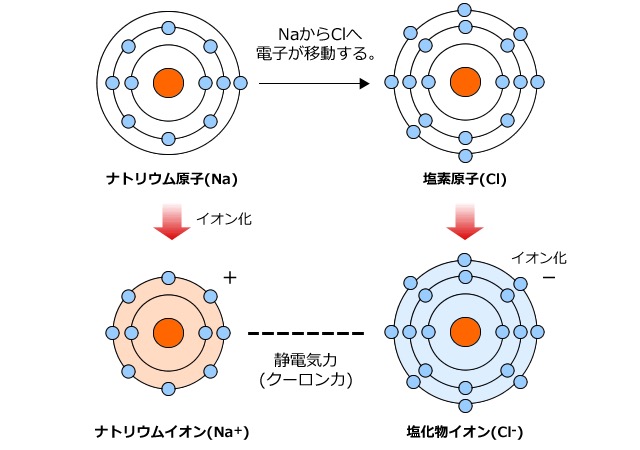
図6:ナトリウムと塩素のイオン化(出典:https://www.sidaiigakubu.com/examination-measure/chemistry/10/)

たくと
「塩化ナトリウム……食塩ですか?」

ミスリー
「ええ。さっきの周期表をもう一度見てみましょうか」
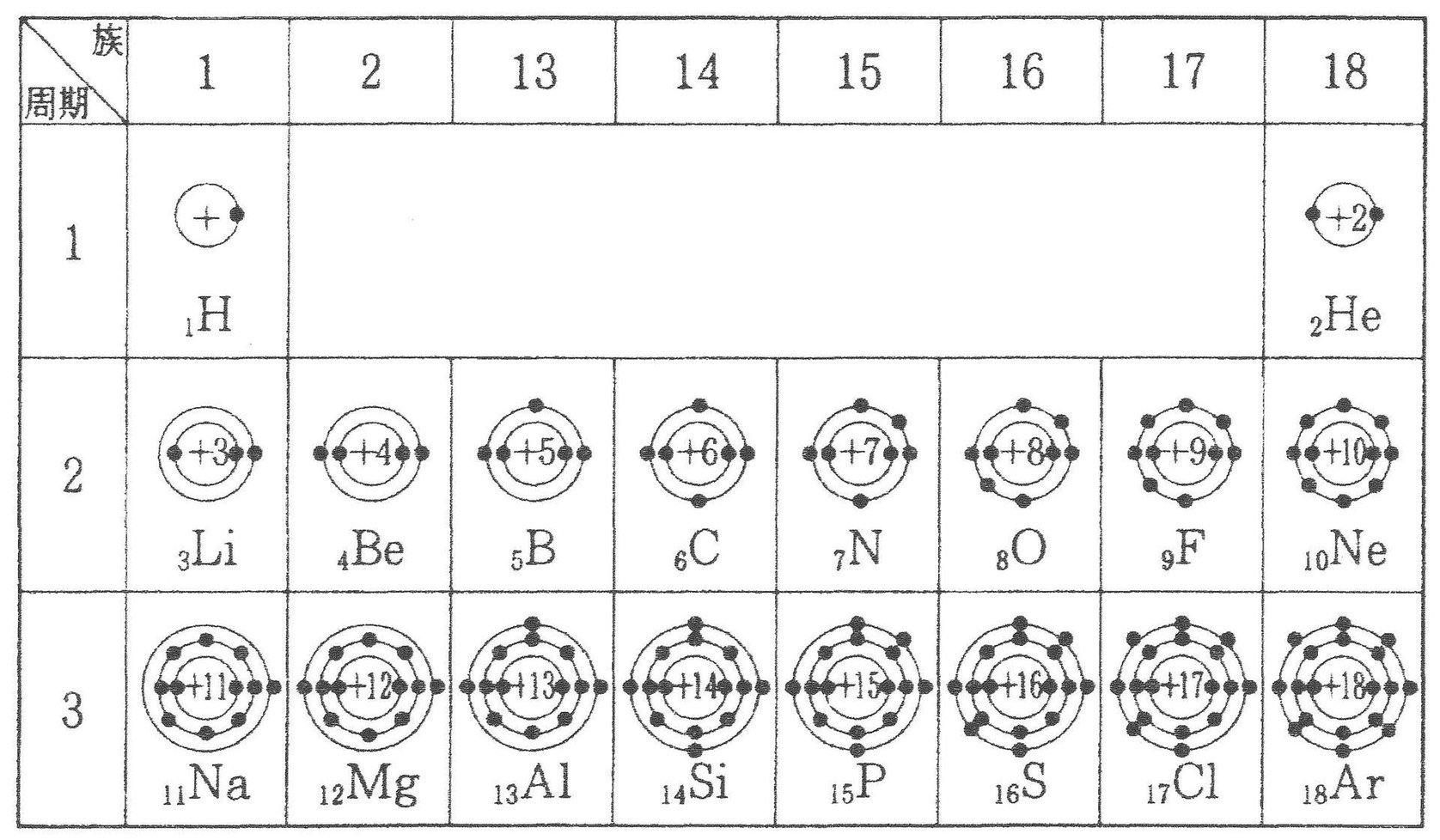
図7:第3周期までの元素とその電子配置図(出典:http://kagakumania.seesaa.net/article/414632984.html)図4を再掲

かがな
「え~っと……
ナトリウム(Na)は一番左の列にあるから、
そのままだと最外殻には電子が1つだけあるんですね」

たくと
「で、塩素(Cl)は一番右から2列目にあるから……
そのままだと安定な状態になれる最外殻電子8つの配置に比べて
電子が1つ足りないってことか」

ミスリー
「そうよ。だからNaは最外殻電子を1つClに渡して、
Clは最外殻の軌道にNaから電子を1つ受け取ることによって、
両方の原子がオクテット則を満たした安定な状態になることができるというわけね。
このときに受け渡すことができる最外殻電子のことを『価電子』と呼んでいるわ」

かがな
「図を見ると、電子のやり取りを行ったNaやClの右肩に
+とか-がついてますね」

ミスリー
「ええ。この状態ではClは電子を1つ受け取っているから、負の電荷が1増えた状態と考えて、これをCl⁻と書くわ。
逆に、Naは負の電荷が1減った状態となっているから、これを正の電荷が1増えた状態と考えて、Na⁺と書くのよ」

たくと
「なるほど。マイナスの電荷が減るのはプラスの電荷が増えるのと同じ……
![]() ということですね」
ということですね」

ミスリー
「そういうことね。
このとき、Na⁺は普通のNaに比べて正の電荷が大きくなっているんだけど、
これを『酸化』されている状態というわ」

かがな
「あっ!酸化!
部誌にたくさん出てきたけどよく分からなかった言葉だ!」

ミスリー
「あら、それはよかったわ。
酸化はね、2段階以上起こることもあるのよ。
たとえば、スズ(Sn)を酸化するとスズ(Ⅱ)イオン(Sn²⁺)になるし、
これをさらに酸化するとスズ(IV)イオン(Sn⁴⁺)になるわ。
この酸化反応を起こさせる物質を『酸化剤』と呼んでいるの」

たくと
「じゃあ、普通のClに比べて負の電荷が大きくなっているCl⁻は……」

ミスリー
「そっちは『還元』されている状態と呼んでいるわ」

たくと
「これが『還元』か!」

かがな
「え~と、じゃあ、さっきの話だと、
スズ(IV)イオン(Sn⁴⁺)を還元するとスズ(Ⅱ)イオン(Sn²⁺)になって、
これをもっと還元するとスズ(Sn)になるんですね!」

たくと
「で、この還元反応を起こさせる物質が『還元剤』ですね!」

ミスリー
「その通り!完璧よ!次が最後の仕上げね。
Na⁺とCl⁻はそれぞれ正と負の電荷を持っているから……」

かがな
「静電気の力で引きあいますね!」

ミスリー
「そう。Na⁺とCl⁻は静電気の力で結合してNaClの結晶になるわ。
このような結合を『イオン結合』と言って、この場合のNa⁺やCl⁻みたいに電子の数が本来に比べて増減している状態を『イオン』と呼ぶのよ」

たくと
「あれ?じゃあそうすると、
Na⁺とか、Cl⁻とかいう物質はどこにあるんですか?」

ミスリー
「そうね。
イオン結合した物質をもとのイオンたちに分ける方法はいろいろあるけど、
いちばん簡単な方法は溶媒に溶かして溶液にすることね」

かがな
「溶媒って確か……水とかでしたっけ?
水に塩を溶かすと、食塩水になって……」

ミスリー
「そうよ。
イオン結合した物質を水に溶かすと、価電子が移動したまま結合が切れて、
それぞれのイオン同士がバラバラになって水溶した状態になるわ。
これを『電離』と呼んでいるの。塩化ナトリウムの電離はこんな式になるわね」

たくと
「なるほど……
これでちょっとは僕たちにも、
部誌に書いてあることが分かるようになったのかな」

ミスリー
「ええ、きっと前より分かるようになっているはずよ。
試しに、このBZ反応の原稿を見てみましょうか」
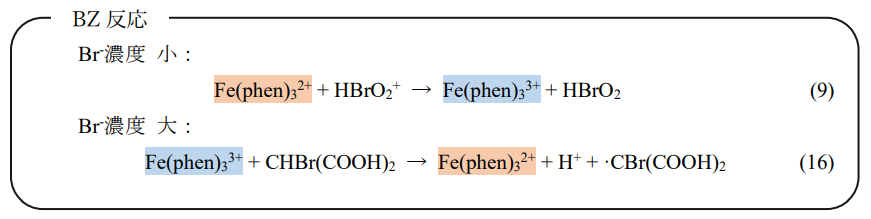

かがな
「う~~~ん……むずかしい……」

ミスリー
「大丈夫よ。
見慣れない化学式が多いけれど、起こっていることそのものは
みんなも知っている酸化還元反応なの」

たくと
「あっ、本当だ!かがな、見てみろ!
上の式も下の式も、反応の前後でFe(phen)3の右上の数字が変わってる!」

ミスリー
「そうよ。数字の小さいFe(phen)3²⁺は赤い色、大きいFe(phen)3³⁺は青い色。
BZ反応は、(9)式の酸化と(16)式の還元が、周りの溶液の濃度によって起こりやすさを変えながら、何度も繰り返し起こることによって、溶液の色が赤と青の間を行ったり来たりする反応なの」

かがな
「そ、そっか!
赤いのも青いのも元々同じ物質だから、
酸化と還元で色を変えたり戻ったりできるんですね!!」

ミスリー
「もっと詳細な部分は部誌に書いてある解説に譲るとして、
酸化と還元がこの反応の真ん中にあること、
そしてそれは決して中学生のみんなにも理解の難しいものではないことは、
分かってくれたかしら?」

かがな
「はいっ!」

たくと
「はい!
よ~しゲームの続きやるぞ~!!」

ミスリー
「うふふ」

たくと
「うわっ!?何だこのペンギン!!」

かがな
「私が選んどいてあげたよ♡」

たくと
「進化したらかっこよくなるんだろうな!?」

かがな
「う~ん、きっとそのままでもかわいいよ!
さ、その子を入れて対戦しよ♡」

ミスリー
「うふふ」
第四章へ続く……